近日,珠海市人民医院精准医疗中心陆骊工教授团队在Nano Today期刊(IF:20.722)发表题为“Second near-infrared photoactivatable hydrogen selenide nanogenerators for metastasis-inhibited cancer therapy”的文章。该研究开发了首个精确调控H2Se水平用于活体抗肿瘤治疗的纳米平台,促进了H2Se在生物医学领域的广泛应用。
本研究转录组测序及分析由中科普瑞合作完成。

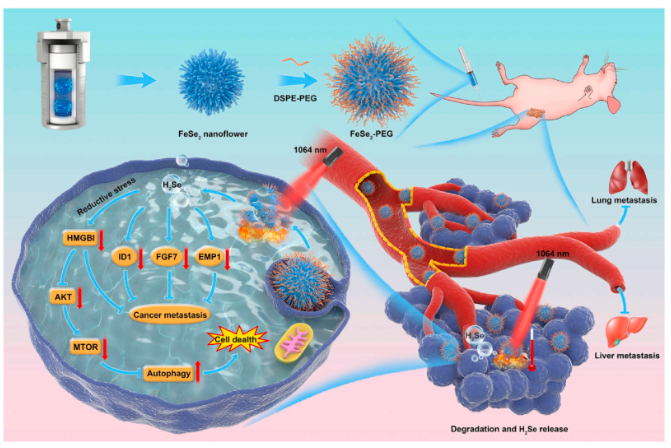
硒作为人体生理必需元素,在体内发挥重要作用,并与许多疾病的发生发展有关。硒化氢(H2Se)是膳食硒化合物常见的代谢中间体,参与生物系统的多种生理过程。但H2Se在体内释放的精确调控目前仍是一个挑战,且此方面的研究较少。近红外(NIR)激光作为一种外部刺激,由于其在时空上的非侵入性和远程可控性,已被广泛应用于生物医学领域。NIR-II光是一种理想的外部刺激,可以在体内精确地调控H2Se水平,实现对肿瘤的无创治疗。本研究开发了聚乙二醇 (PEG) 修饰的硒化亚铁 (FeSe2-PEG) 纳米花,照射NIR-II 后降解释放 H2Se ,用于光热气法协同治疗癌症。
主要研究结果展示
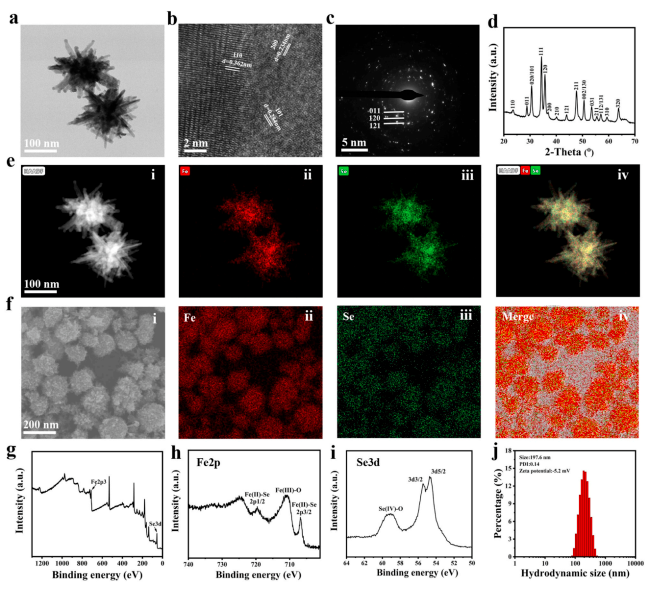
FeSe2-PEG的合成与表征
通过热溶剂反应合成 FeSe2纳米花,选择DSPE-PEG2000通过超声分散对FeSe2进行改性,产生流体动力学大小为197.6 nm和zeta电位为-5.2 mV的FeSe2-PEG纳米花,赋予产品水稳定性。在 PBS 和细胞培养基中孵育 24 小时后,FeSe2-PEG 的流体力学大小几乎保持不变,表明其具有良好的胶体稳定性,可应用于生物医学。
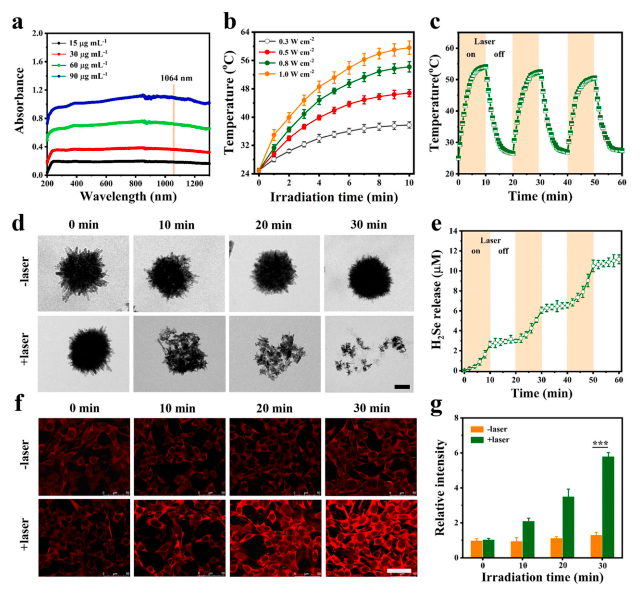
FeSe2-PEG纳米花的光热效应及H2Se的生成
FeSe2-PEG制备成功后,利用激光照射对产物的光热效应进行探索,发现在 1064 nm 激光(0.8 W cm -2)照射 30 分钟后,FeSe2-PEG 逐渐分解为小纳米颗粒,而在无激光照射时FeSe2-PEG形态几乎保持不变。低氧条件下,用NIR-II激光间隔10分钟照射FeSe2- PEG溶液进行H2Se检测,结果表明NIR-II激光辐照FeSe2-PEG溶液可按需释放H2Se。
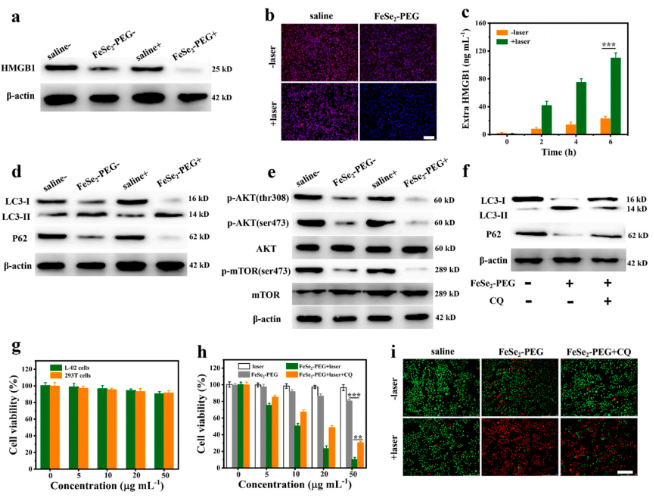
体外实验 - HMGB1蛋白分析及自噬标志物分析
H2Se是一种高还原性气体分子,其积累最终影响肿瘤细胞的氧化还原平衡。据报道,氧化还原敏感蛋白(如 HMGB1)的表达水平受细胞中氧化还原状态影响。本研究探索了 FeSe2-PEG 释放的 H2Se 对 4T1 细胞中HMGB1表达的影响,发现在 NIR-II激光(0.8 W cm -2)照射下,FeSe2-PEG溶液释放的H2Se下调了4T1肿瘤细胞中HMGB1蛋白的表达。进一步研究发现FeSe2-PEG 加激光照射产生的H2Se积累可明显抑制Akt/mTOR信号通路,诱导细胞自噬。细胞毒性实验也证实H2Se对癌细胞的毒性。
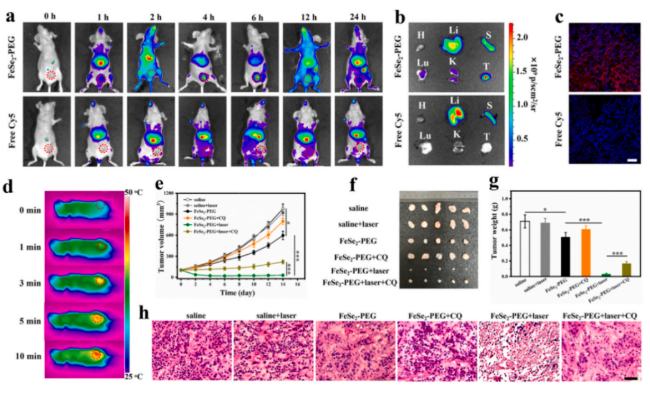
体内实验—NIR-II激光照射后FeSe2-PEG体内分布及抗肿瘤作用
采用小鼠尾静脉注射,追踪不同时间点血液中的荧光信号,探索了 FeSe2-PEG 的药代动力学特征,近红外荧光 (NIRF) 评估 FeSe2-PEG 在体内的生物分布。结果发现,静脉注射FeSe2-PEG后肿瘤组织中发现明显的荧光信号,肿瘤区域观察到强荧光信号,而游离Cy5处理小鼠在肝脏中发现大部分荧光信号。加激光照射后,4T1荷瘤小鼠的肿瘤生长抑制效果显著。
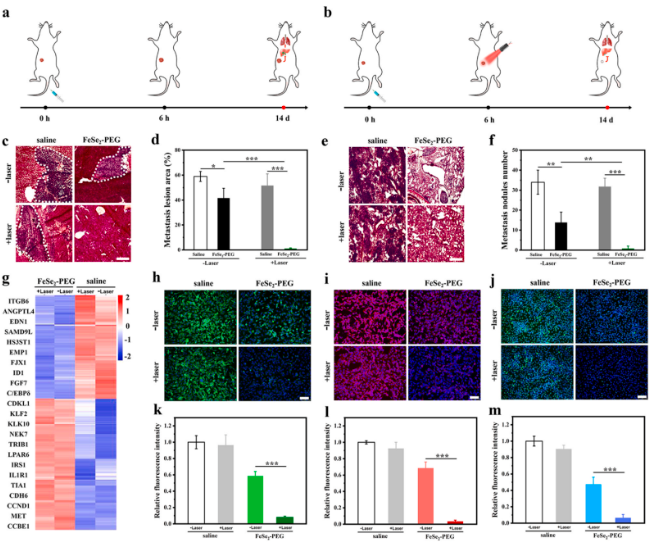
体内抗转移评价及分子机制研究
鉴于HMGB1已被证实能促进肿瘤细胞迁移,本研究进一步探索了H2Se积累是否影响肿瘤转移。小鼠不同治疗方案体内肝脏和肺转移监测显示,光热增强 H2Se 疗法几乎完全阻止了远处癌症的转移,这是其他单独疗法无法做到的。通过RNA测序及定量分析不同治疗后肿瘤转移相关蛋白表达水平,发现经FeSe2- PEG 加激光照射后,几种转移相关蛋白如上皮膜蛋白1 (EMP1)、分化抑制蛋白1 (ID1)、成纤维细胞生长因子7 (FGF7)均明显下调,表明H2Se的释放可以下调转移相关蛋白的表达,从而完全抑制肝和肺转移。
小 结
本研究首次开发了具有生物相容性的FeSe2-PEG纳米花,通过近红外光活化实现H2Se的按需释放,用于癌症治疗。FeSe2-PEG具有良好的光热转换效果,在NIR-II激光照射下可释放H2Se,并表现出良好的肿瘤聚集效应。H2Se在癌细胞中的持续积累可引起细胞死亡。此外,H2Se的局部生成下调转移相关蛋白的表达水平,有助于完全抑制肝和肺转移。本研究的结果为实现H2Se水平在体内的可控性提供了一个纳米平台,为H2Se在肿瘤转移抑制治疗中的应用提供了治疗策略,为H2Se在生物医学领域的应用奠定了坚实基础。
FeSe2-PEG + NIR-II光激活H2Se释放治疗癌症示意图


